Reacciones redox: cómo la química mueve electrones y transforma la materia.
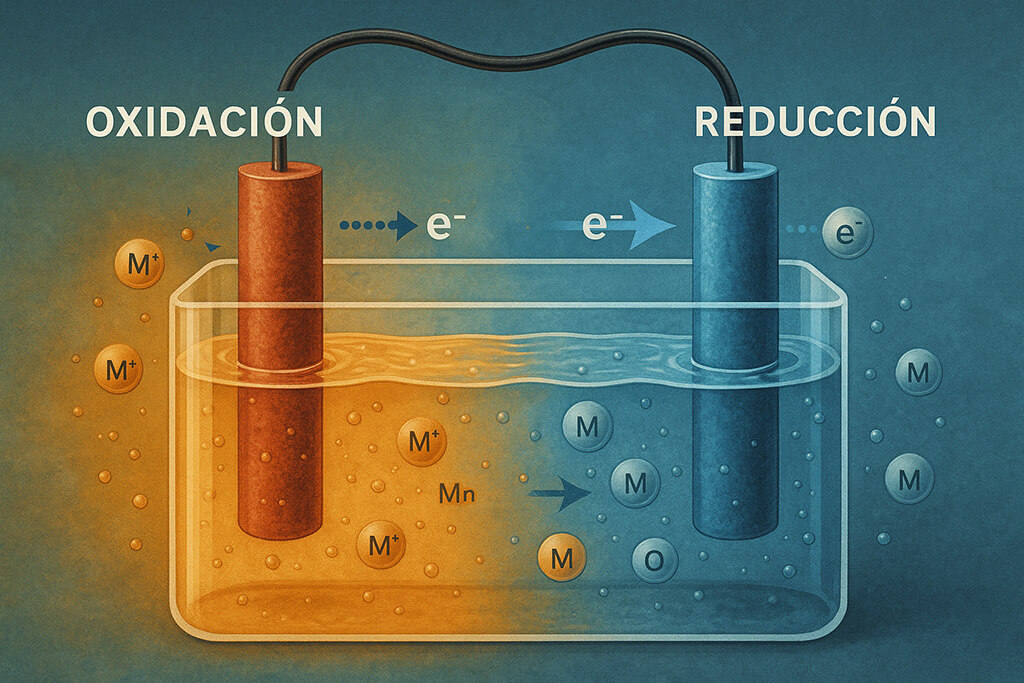
En la base de innumerables procesos químicos que ocurren a nuestro alrededor, desde el funcionamiento de una batería hasta la respiración celular, se encuentran las reacciones redox. Son esenciales en la química porque implican algo fundamental: la transferencia de electrones entre átomos o moléculas. Sin estos intercambios, no habría vida, energía eléctrica ni combustión.
Entender las reacciones redox nos permite comprender fenómenos naturales y aplicaciones tecnológicas, tanto a nivel microscópico como a escala industrial. En este artículo te explicamos de forma clara qué son, cómo identificarlas y por qué tienen tanto impacto.
¿Qué son las reacciones redox?
El término redox es una abreviación de dos procesos opuestos pero complementarios: oxidación y reducción. Una sustancia se oxida cuando pierde electrones y se reduce cuando los gana.
En una reacción redox siempre hay un donador de electrones (el agente reductor) y un receptor (el agente oxidante). Es decir, si algo se oxida, otra cosa debe reducirse simultáneamente.
Un ejemplo clásico es la oxidación del hierro:
Fe + O₂ → Fe₂O₃ (óxido de hierro, o herrumbre)
En esta reacción, el hierro pierde electrones (se oxida) y el oxígeno los gana (se reduce), formando una nueva sustancia.
Claves para identificar una reacción redox.
Para reconocer una reacción redox, podemos fijarnos en algunos indicadores:
-
Cambio en el número de oxidación de los elementos involucrados. Si un átomo aumenta su número de oxidación, se ha oxidado; si lo disminuye, se ha reducido.
-
Presencia de elementos puros que se convierten en compuestos, o viceversa.
-
Transferencia de electrones observable en celdas galvánicas o electrolíticas.
Ejemplo de reacción redox con números de oxidación:
Zn⁰ + Cu²⁺ → Zn²⁺ + Cu⁰
El zinc se oxida (pasa de 0 a +2) y el cobre se reduce (de +2 a 0).
Tipos de reacciones redox más comunes.
Reacciones de combustión.
Son quizá las más familiares: un material reacciona con oxígeno y libera energía en forma de calor y luz.
CH₄ + 2O₂ → CO₂ + 2H₂O
Aquí, el metano se oxida y el oxígeno se reduce. Este tipo de reacción ocurre en motores, cocinas, y hasta en velas encendidas.
Reacciones de corrosión.
Como la oxidación del hierro, implican la degradación de metales por acción de agentes oxidantes, como el oxígeno o el agua salada.
Reacciones en células electroquímicas.
Tanto las pilas (como las alcalinas) como los acumuladores (como los de los coches eléctricos) funcionan gracias a reacciones redox controladas, donde el flujo de electrones genera electricidad.
Respiración celular y fotosíntesis.
En biología también hay procesos redox fundamentales. En la respiración celular, la glucosa se oxida y el oxígeno se reduce, liberando energía.
C₆H₁₂O₆ + 6O₂ → 6CO₂ + 6H₂O
En la fotosíntesis, ocurre lo contrario: el dióxido de carbono se reduce para formar glucosa y el agua se oxida liberando oxígeno.
¿Qué es el número de oxidación?
El número de oxidación (NO) indica la carga que tendría un átomo si los electrones de sus enlaces fueran completamente transferidos. Aunque es una herramienta teórica, es extremadamente útil para identificar si un elemento ha ganado o perdido electrones en una reacción.
Por ejemplo:
-
El oxígeno en casi todos los compuestos tiene NO = -2.
-
El hidrógeno suele tener NO = +1.
-
Los elementos libres siempre tienen NO = 0.
Saber asignar correctamente estos números permite balancear ecuaciones redox de forma precisa, sobre todo en soluciones acuosas.
¿Cómo se balancea una reacción redox?
Las reacciones redox pueden parecer complejas, pero se pueden balancear sistemáticamente siguiendo el método del ion-electrón (también conocido como método del ion-electrón en medio ácido o básico).
Este método implica:
- Separar la reacción en dos semirreacciones: una de oxidación y una de reducción.
- Balancear los átomos que no sean oxígeno o hidrógeno.
- Balancear oxígenos con H₂O.
- Balancear hidrógenos con H⁺ (en medio ácido) o OH⁻ (en medio básico).
- Balancear cargas con electrones.
- Igualar el número de electrones y sumar las semirreacciones.
Este procedimiento es muy utilizado en química inorgánica, en especial en reacciones complejas.
Aplicaciones prácticas de las reacciones redox.
Las reacciones redox están en el corazón de numerosos procesos cotidianos e industriales:
-
Pilas y baterías: como las de ion-litio, que alimentan desde móviles hasta coches eléctricos.
-
Purificación de metales: como la obtención de aluminio por electrólisis.
-
Tratamiento de aguas: usando agentes oxidantes para eliminar contaminantes.
-
Análisis químicos: como la valoración redox en laboratorio para determinar concentraciones.
-
Síntesis industrial: en la producción de ácido nítrico, cloro o metales puros.
También son claves en avances como las pilas de combustible, donde el hidrógeno se oxida y genera electricidad sin combustión.
¿Por qué son tan importantes en la ciencia?
Las reacciones redox son uno de los pilares de la química moderna, porque están asociadas a los cambios de energía, la formación de enlaces, y la transformación de la materia.
En muchos sentidos, entender la química redox es entender cómo el universo gestiona la energía. Desde la corrosión de un puente hasta las estrellas que brillan en el cielo, todo involucra oxidación y reducción.
Además, dominar estos conceptos es esencial para estudiantes, ingenieros, biólogos y profesionales de múltiples disciplinas.
Un mundo que gira gracias a los electrones.
Las reacciones redox no son un tema aislado de laboratorio: están en cada rincón de nuestra vida. Permiten que nuestros cuerpos funcionen, que nuestros dispositivos se enciendan y que la naturaleza evolucione.
Estudiarlas no solo nos ayuda a comprender el presente, sino también a diseñar tecnologías más limpias, eficientes y sostenibles. Porque al final, la química no es solo la ciencia de los elementos, sino la historia de cómo la materia se transforma moviendo electrones.


